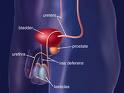
 La prostata è una ghiandola maschile che si trova al di sotto della vescica e davanti al retto; circonda l’uretra, il condotto che permette all’urina e al liquido seminale di fuoriuscire dal pene. La prostata produce parte del fluido che trasporta gli spermatozoi durante l’eiaculazione. Le dimensioni e la forma della ghiandola sono estremamente variabili: nell’uomo adulto ha la grandezza di una castagna (20g). Dai 40-45 anni di età in poi, per azione dell’ormone Diidrotestosterone, la prostata tende ad aumentare
La prostata è una ghiandola maschile che si trova al di sotto della vescica e davanti al retto; circonda l’uretra, il condotto che permette all’urina e al liquido seminale di fuoriuscire dal pene. La prostata produce parte del fluido che trasporta gli spermatozoi durante l’eiaculazione. Le dimensioni e la forma della ghiandola sono estremamente variabili: nell’uomo adulto ha la grandezza di una castagna (20g). Dai 40-45 anni di età in poi, per azione dell’ormone Diidrotestosterone, la prostata tende ad aumentare  progressivamente di volume per l’incremento nel numero delle cellule prostatiche: questo fenomeno è definito iperplasia prostatica benigna o IPB. L’IPB non è un tumore maligno e non conduce al tumore della prostata. Poiché interessa la parte centrale della ghiandola e comprime l’uretra, può interferire con la normale funzione urinaria; il paziente potrà, quindi, avvertire dei disturbi quali: getto urinario debole, sensazione di incompleto svuotamento vescicale post-minzione, aumento della frequenza minzionale e levate notturne. In condizioni normali le cellule si riproducono, uguali a loro stesse, per sostituire le cellule danneggiate o malfunzionanti. La neoplasia è
progressivamente di volume per l’incremento nel numero delle cellule prostatiche: questo fenomeno è definito iperplasia prostatica benigna o IPB. L’IPB non è un tumore maligno e non conduce al tumore della prostata. Poiché interessa la parte centrale della ghiandola e comprime l’uretra, può interferire con la normale funzione urinaria; il paziente potrà, quindi, avvertire dei disturbi quali: getto urinario debole, sensazione di incompleto svuotamento vescicale post-minzione, aumento della frequenza minzionale e levate notturne. In condizioni normali le cellule si riproducono, uguali a loro stesse, per sostituire le cellule danneggiate o malfunzionanti. La neoplasia è  caratterizzata, invece, dalla crescita incontrollata di cellule anomale. Alcuni tumori sono benigni (non cancerosi), mentre altri (maligni) possono invadere e distruggere un organo, estendendosi nel tempo agli organi adiacenti o addirittura disseminandosi in altre zone del corpo (metastasi). Il tumore prostatico maligno più frequente è l’adenocarcinoma della prostata.
caratterizzata, invece, dalla crescita incontrollata di cellule anomale. Alcuni tumori sono benigni (non cancerosi), mentre altri (maligni) possono invadere e distruggere un organo, estendendosi nel tempo agli organi adiacenti o addirittura disseminandosi in altre zone del corpo (metastasi). Il tumore prostatico maligno più frequente è l’adenocarcinoma della prostata.
Il rischio di sviluppare l’adenocarcinoma prostatico, basso nei pazienti con meno di 40 anni, aumenta progressivamente con l’età. Un uomo nel corso della vita presenta un rischio di sviluppare un carcinoma prostatico clinicamente evidente pari a circa il 15%. La causa precisa di questa patologia non è nota. Recenti studi epidemiologici dimostrano che negli Stati Uniti il tumore della prostata è la più frequente neoplasia nell’uomo (244.000 nuovi casi diagnosticati nel solo anno1995, in continuo aumento per il progressivo invecchiamento della popolazione e per l’utilizzo dell’antigene prostatico specifico -PSA- come strumento di screening); esso rappresenta a tutt’oggi la seconda causa di morte per neoplasia dopo il tumore del polmone (44.000 decessi nel solo 1995 negli USA). Negli stadi iniziali il tumore prostatico è confinato alla ghiandola: essendo, generalmente, caratterizzato da crescita molto lenta, può restare asintomatico e non diagnosticato per anni; in taluni casi, addirittura, non è in grado di alterare, anche se non curato, la qualità e la spettanza di vita del paziente.
La causa precisa di questa patologia non è nota. Recenti studi epidemiologici dimostrano che negli Stati Uniti il tumore della prostata è la più frequente neoplasia nell’uomo (244.000 nuovi casi diagnosticati nel solo anno1995, in continuo aumento per il progressivo invecchiamento della popolazione e per l’utilizzo dell’antigene prostatico specifico -PSA- come strumento di screening); esso rappresenta a tutt’oggi la seconda causa di morte per neoplasia dopo il tumore del polmone (44.000 decessi nel solo 1995 negli USA). Negli stadi iniziali il tumore prostatico è confinato alla ghiandola: essendo, generalmente, caratterizzato da crescita molto lenta, può restare asintomatico e non diagnosticato per anni; in taluni casi, addirittura, non è in grado di alterare, anche se non curato, la qualità e la spettanza di vita del paziente. 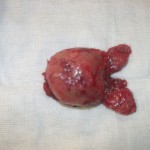
Alcuni tumori prostatici possono essere invece molto aggressivie diffondersi velocemente ad altre parti del corpo (soprattutto a livello linfonodale ed osseo): in questi casi una diagnosi precoce ed un trattamento adeguato possono risultare di vitale importanza. Purtroppo allo stato attuale delle conoscenze scientifiche non è possibile sapere con certezza se una neoplasia prostatica si comporterà in modo aggressivo oppure no. Di conseguenza, in presenza di una diagnosi di cancro della prostata, si opta quasi sempre per un trattamento terapeutico, anche se questo porta talvolta a trattare delle neoplasie che non avrebbero modificato la aspettativa di vita del paziente. Negli Stati Uniti circa il 20% dei soggetti con diagnosi clinica, o manifesta, di cancro prostatico muore per la malattia nonostante una terapia specifica; in Svezia, dove il cancro prostatico non viene trattato con intento curativo, il 55% dei soggetti muore per la malattia. Questi dati evidenziano come una diagnosi precoce ed una adeguata terapia possano consentire la guarigione nella maggior parte dei pazienti e ridurre in modo significativo il tasso di mortalità specifico. Poiché la terapia per qualsiasi forma di cancro dovrebbe essere, oltre che efficace, ben tollerata e garantire una adeguata qualità della vita, è cresciuta in ambito scientifico l’attenzione verso alternative terapeutiche che consentano di conseguire gli stessi risultati oncologici ottenuti con l’intervento chirurgico, ma con minori complicanze ed effetti collaterali.
STADIAZIONE DEL TUMORE PROSTATICO
Una diagnosi precoce ed una adeguata terapia consentono la guarigione nella maggior parte dei pazienti affetti da tumore prostatico; sfortunatamente la maggior parte di questi pazienti non ha alcun sintomo. L’esplorazione rettale, che per anni ha rappresentato la sola tecnica diagnostica, permette il riconoscimento di alterazioni nella consistenza del tessuto prostatico e quindi la diagnosi di tumori in stadio avanzato, ma non consente l’individuazione della maggior parte dei tumori allo stadio iniziale. Il PSA (antigene prostatico specifico) è una glicoproteina prodotta normalmente dalle cellule della ghiandola prostatica, la cui concentrazione nel sangue aumenta sensibilmente qualora le strutture ghiandolari vengano danneggiate (tumore prostatico, infezioni, iperplasia prostatica benigna). Attualmente, il dosaggio del PSA nel sangue può consentire una diagnosi precoce di tumore prostatico: approssimativamente il 70-80% dei tumori prostatici viene diagnosticato quando la malattia è ancora organo confinata
(rispetto al solo 20-30% nell’epoca pre-PSA). Le terapie più efficaci sono in grado di guarire circa l’80% dei pazienti affetti da carcinoma localizzato.
Lo screening consigliato prevede il dosaggio del PSA ed una visita specialistica urologica annualmente a partire dai 50 anni di età; soggetti con un’anamnesi familiare per carcinoma prostatico dovrebbero entrare nel programma di screening dai 40 anni di età. Tradizionalmente il valore di 4,0 ng/ml di PSA è ritenuto il valore massimo normale.
Poiché il 20% dei pazienti con diagnosi di tumore prostatico ha un PSA inferiore a 4,0 ng/ml, nei soggetti più giovani (sotto i 50 anni), nei quali una diagnosi precoce ed un trattamento aggressivo potrebbero essere massimamente efficaci, il valore di 2,5 ng/ml rappresenta oggi il valore massimo accettato. Per contro il 70% dei soggetti con PSA superiore a 4,0 ng/ml non ha un carcinoma della prostata. Il PSA risulta un marker tumorale estremamente sensibile ma scarsamente specifico, l’urologo può avvalersi, per aumentare la precisione diagnostica, di alcuni parametri: la velocità di crescita annuale del PSA (PSA velocity), la concentrazione del PSA rispetto al volume ghiandolare (PSA density), il
rapporto del PSA rispetto all’età del paziente ed il dosaggio del PSA libero ( la cui quota è minore in soggetti portatori di carcinoma rispetto a quella dei pazienti affetti da iperplasia benigna).
Il solo valore del PSA non è diagnostico; ulteriori indagini, quali l’ ecografia prostatica transrettale e le biopsie prostatiche ecoguidate, sono indispensabili per una diagnosi sicura di carcinoma prostatico. L’ecografia prostatica viene eseguita mediante l’introduzione di una sonda ecografica nel retto del paziente. Questa metodica consente di valutare la morfologia, le dimensioni e la struttura della ghiandola mentre è scarsamente sensibile nello screening tumorale. L’ecografia consente in particolare di guidare con precisione all’ interno della ghiandola un sottilissimo ago per eseguire biopsie multiple (prelievo di piccoli pezzettini di tessuto utilizzati per esame istologico). Lo Specialista sommando le informazioni che gli derivano dal PSA e dal referto istologico delle biopsie prostatiche, nonché dalla esplorazione rettale e dalla ecografia transrettale,
dovrà individuare quei pazienti affetti da neoplasia clinicamente localizzata candidabili ad una terapia curativa.
La scelta del trattamento nel paziente affetto da adenocarcinoma prostatico non può prescindere da differenti fattori quali l’età e lo stato di salute generale del paziente, ma soprattutto dalla estensione (o stadio) della malattia. Le informazioni disponibili per stabilire l’estensione del tumore sono la esplorazione rettale, i valori di PSA ed il grado istologico (differenza delle cellule rispetto al normale); talvolta si ricorre alla diagnostica radiologica e alla linfectomia pelvica.
GRADING DEL TUMORE PROSTATICO
Esistono dei nomogrammi che correlando i risultati di esplorazione rettale, PSA e grado istologico quantificano la probabilità che la patologia sia ancora o meno organo-confinata (Tabelle di Partin, formula di Roach III) La Tomografia computerizzata (TAC) e la Risonanza Magnetica (RMN) non vengono utilizzate routinariamente a causa della loro bassa sensibilità nel valutare l’ estensione locale della malattia e la presenza di malattia metastatica; sono indicate in pazienti ad alto rischio di avere un carcinoma non più localizzato (sulla scorta della esplorazione rettale, di un PSA superiore a 20 ng/ ml o di un riscontro istologico di una forma molto aggressiva). La scintigrafia ossea (eseguita per evidenziare eventuali metastasi ossee) è indicata nei pazienti con PSA di partenza superiore a 10 ng/ml. La linfectomia pelvica stadiante (laparoscopica o chirurgica) è indicata quando sussista un forte sospetto di metastasi linfonodali (dubbio alla TAC o alla RMN, riscontro di un PSA superiore a 20 ng/ml, tumore prostatico molto aggressivo o esplorazione rettale patologica). Ad uso del paziente, viene di seguito riassunta la suddivisione in stadi dell’adenocarcinoma della prostata sulla scorta dell’ esame clinico, della diagnostica per immagini ,degli esami ematici e del referto istologico.
CATEGORIA T
Stadio T1: Tumore clinicamente non palpabile né visibile con la diagnostica per immagini, diagnosticato mediante agobiopsia (eseguita per un PSA elevato) o scoperto casualmente con
l’esame istologico di tessuto asportato durante un’intervento sulla prostata.
Stadio T2: Il tumore è ancora confinato alla ghiandola prostatica e non supera la capsula, ma è cresciuto al punto da divenire palpabile alla esplorazione rettale o visualizzabile con l’ecografia o altre metodiche di imaging.
Stadio T3: Il tumore ha superato la capsula prostatica (T3a) e/o ha invaso le vescicole seminali (T3b).
Stadio T4: Il tumore ha infiltrato strutture adiacenti la prostata, quali il retto o la vescica, lo
sfintere esterno o i muscoli della parete pelvica. In questo stadio possono comparire dei sintomi specifici.
CATEGORIA N
Nx Linfonodi regionali non valutabili N zero Linfonodi regionali liberi da metastasi N1 Metastasi nei linfonodi regionali
CATEGORIA M
Mx Metastasi a distanza non accertabili
M zero Metastasi a distanza assenti
M1 Metastasi a distanza presenti
Di ogni tumore prostatico occorre definire oltre alla estensione (stadio), il “grading” o differenza istologica rispetto al normale (indice di minore o maggiore aggressività della patologia). Questa valutazione viene eseguita sui frammenti di tessuto prostatico asportati con le biopsie. Le cellule normali hanno caratteristiche distintive che vengono perse dalle cellule tumorali in misura proporzionale alla aggressività della neoplasia.
Ci sono diversi sistemi di grading cellulare; il più comune è la somma dei punteggi di Gleason. Tale somma varia da un valore minimo di 2 ad un massimo di 10. I valori più bassi (2-4) indicano una malattia poco aggressiva e con progressione più lenta. Un punteggio compreso tra 5 e 7 esprime un aspetto intermedio mentre una somma tra 8 e 10 indica che le cellule tumorali hanno caratteristiche di elevata aggressività.
TRATTAMENTO DEL TUMORE PROSTATICO LOCALIZZATO
In particolare il valore della somma di Gleason è dato dalla somma di due punteggi che identificano le caratteristiche istologiche predominanti nel preparato e quelle più aggressive (a ciascuna caratteristica viene dato un punteggio da 1 a 5 , in cui 1 indica una neoplasia poco aggressiva mentre 5 molto aggressiva).
La scelta del trattamento nel paziente affetto da adenocarcinoma prostatico non può prescindere da differenti fattori quali l’età e lo stato di salute generale del paziente, ma soprattutto dal grado di aggressività della malattia. Nello sviluppo di un piano di cura è importante lo scambio di informazioni tra medico e paziente, per discutere i vantaggi e gli svantaggi di ogni possibile trattamento .
Nel nostro centro viene praticata anche la tecnica laparoscopica e la tecnica robotica. 
La prostatectomia radicale (PR) è una procedura di chirurgia maggiore, durante la quale il chirurgo rimuove in blocco la ghiandola prostatica e le vescicole seminali. L’ intervento viene condotto usualmente attraverso una incisione sulla parte inferiore dell’addome (PR retropubica); altri Autori preferiscono l’accesso transperineale (regione tra scroto e ano) o transcoccigeo posteriore.
La PR è attualmente considerata il “gold standard” per la cura del tumore prostatico localizzato, in virtù delle elevate percentuali di cura ottenute e della disponibilità di risultati a lungo termine (pazienti operati da più di 15 anni), che ne fanno il trattamento di elezione nei pazienti giovani (sempre più numerosi grazie alla diagnosi precoce consentita dall’introduzione del PSA).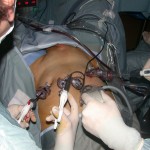
Sebbene il perfezionamento e la divulgazione di alcuni passaggi di tecnica chirurgica (tecnica “nerve-sparing” o con risparmio dei fasci vasculonervosi) abbiano consentito una importante riduzione delle complicanze post-chirurgiche (quantomeno nei centri di riferimento), la loro frequenza e l’impatto sulla qualità della vita dei malati, impongono una accurata selezione dei pazienti : questi dovranno essere informati sui vantaggi e gli svantaggi della metodica e sulle relative indicazioni.
Da pochi anni alcuni Centri, compreso il nostro,eseguono la PR in laparoscopia: questo approccio miniinvasivo, pur necessitando ancora di lunghi tempi operatori anche per esperti laparoscopisti, risulta estremamente interessante perché minimizza alcuni degli svantaggi dell’intervento chirurgico tradizionale (dimissione, rimozione del catetere vescicale e ritorno alla normale vita socio-lavorativa più precoci; minori perdite ematiche intraoperatorie, riduzione delle infezioni). Dal luglio 2007 eseguiamo, in casi selezionati, anche la chirurgia robotica, il nostro è il primo centro della toscana e del centro italia di chirurgia urologica robotica.
La probabilità di sopravvivenza libera da progressione biochimica di malattia (risalita del PSA) dopo prostatectomia radicale per un tumore localizzato è a 5, 10, 15 anni pari rispettivamente al 83-94%, 53-91% e 40-57%; i fattori più importanti nel determinare il risultato oncologico sono il grado (grading) di aggressività della neoplasia ed il PSA preoperatorio.
Vantaggi procedura che si conclude in una unica seduta
l’asportazione in toto della ghiandola consente:
la rimozione dall’organismo di tutto il tumore e quindi la sua cura se questo era confinato alla prostata un follow-up semplificato dopo il trattamento (disponibilità della stadiazione patologica del tumore ed azzeramento del PSA) che riduce lo stato d’ansia del paziente ai controlli il trattamento concomitante dei disturbi conseguenti all’ipertrofia prostatica
disponibilità di risultati a lungo termine (>15 anni)
costi ridotti rispetto alla BT
Svantaggi procedura invasiva, di chirurgia maggiore
necessita di ospedalizzazione(6-14 giorni)
maggiore durata della anestesia rispetto alla BT
catetere vescicale a dimora per 5-14 giorni
tardivo ritorno alla normale vita socio-lavorativa (4 settimane)
rischio di complicanze e risultati massimamente operatore-dipendenti
rischio di complicanze intra, peri e post operatorie riportato dai migliori Centri Internazionali: globalmente 7,5-18,5%
Rischio di complicanze intra e perioperatorie:
mortalità operatoria <0,5% e perioperatoria 0-1,5% sanguinamento con necessità di emotrasfusioni 4-10% trombo- embolie 0,7-2,6% problematiche cardio-vascolari 0,4-1,4% lesioni della parete del retto 0,1-2% infezioni della ferita 0,9-1,3%
Rischio di complicanze post operatorie:
deficit erettile (impotenza) dopo intervento nerve-sparing mono o bilaterale 10-75% (correlato alla età del paziente, allo stadio clinico e patologico della malattia e alla tecnica chirurgica) incontinenza urinaria minima (richiede 1 assorbente al di) a 18 mesi 6-17% incontinenza urinaria severa o totale (richiede >2 assorbenti al di o il posizionamento di uno sfintere artificiale) a 18 mesi 0-12,5%
Conclusioni-Indicazioni
La Prostatectomia radicale può quindi essere proposta a tutti i pazienti affetti da adenocarcinoma prostatico localizzato, ed in particolare a coloro che presentino le seguenti caratteristiche:
aspettativa di vita di almeno 10 anni senza controindicazioni ad una chirurgia maggiore e/o alla anestesia informati sulle indicazioni e le possibili complicanze giovani con malattia aggressiva (disponibilità di risultati >15 anni) ostruiti, in quanto la ghiandola prostatica che ostruisce il deflusso dell’urina viene rimossa in blocco per i quali l’obiettivo psicologico primario dopo la terapia, a comprovarne l’efficacia, sia l’azzeramento del PSA (generalmente pazienti pervenuti alla diagnosi dopo un lungo iter caratterizzato da molteplici agobiopsie e ripetuti controlli del PSA per valori border-line o fluttuanti)
La Prostatectomia radicale può essere invece controindicata nei pazienti:
in età avanzata ad alto rischio anestesiologico e/o operatorio a rischio per patologie trombo-emboliche affetti da turbe della coagulazione con forte motivazione al mantenimento della potenza sessuale e di una perfetta continenza urinaria che richiedano un rapido ritorno alla normale vita socio-lavorativa
L’intervento di prostatectomia radicale viene usualmente proposto come monoterapia; in alcuni casi selezionati e per differenti ragioni lo Specialista potrà invece far precedere l’intervento da un ciclo di terapia ormonale definito neoadiuvante.
Infissione transperineale di semi radioattivi nella prostata controllata mediante ecografia transrettale
BRACHITERAPIA – IMPIANTO PERMANENTE
La Brachiterapia permanente (BT) è una forma di radioterapia in cui delle piccole capsule (“semi” delle dimensioni di chicchi di riso) contenenti sorgenti radioattive (Palladio 103/Pd-103 o Iodio 125/I-125) vengono impiantate nella prostata sotto guida ecografica. Si tratta di una procedura minimamente invasiva che si completa in un’unica seduta operatoria della durata di circa 90 minuti. 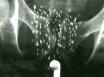
I “semi” vengono posizionati nella prostata mediante aghi infissi per via transperineale (la regione fra scroto e ano). La sonda ecografica e gli aghi vengono estratti al termine della procedura. Ciascun “seme” rilascia continuamente una piccola quantità di energia radiante ad una limitata porzione di tessuto prostatico: questo consente di trattare il tumore con una dose di radiazione estremamente elevata senza danneggiare le strutture adiacenti. Dopo alcune settimane i “semi” avranno rilasciato la maggior parte della loro energia (tempo effettivo di trattamento) e resteranno per sempre nella prostata in forma non più attiva senza essere percepiti dal paziente. La pubblicazione dei risultati oncologici ottenuti nei pazienti trattati con questa innovativa tecnica di impianto per carcinoma localizzato della prostata, ha suscitato enorme interesse in ambito scientifico: infatti le percentuali di cura sulle prime serie di pazienti trattati circa 12 anni fa, sono risultate sovrapponibili a quelle ottenute con la chirurgia ( intervento di prostatectomia radicale) e superiori a quelle conseguite con la radioterapia convenzionale a fasci esterni (comparazioni retrospettive). La Brachiterapia (BT) può essere proposta in alternativa all’intervento chirurgico di prostatectomia radicale nei pazienti affetti da adenocarcinoma prostatico clinicamente localizzato. Ciascun paziente presenta caratteristiche cliniche, fisiche e psicologiche che porteranno il medico a suggerire il trattamento più idoneo (Brachiterapia, intervento chirurgico o altre forme di trattamento del tumore prostatico). L’elenco dei principali vantaggi e svantaggi di questa metodica, di seguito riportato, può aiutare il paziente nella scelta terapeutica.
Vantaggi procedura attuabile in day-surgery, miniinvasiva, che si conclude in un’unica seduta:
limitata durata dell’anestesia (circa 90 minuti)
sanguinamento nullo o minimo (non sono necessarie trasfusioni)
rischio di complicanze tromboemboliche minimo
rimozione del catetere vescicale entro le 24 ore dall’impianto
rapido ritorno alle normali attività socio-lavorative (pochi giorni)
rischio di incontinenza urinaria 1%
mantenimento della potenza sessuale 90-50% dei casi (a seconda dell’età del Pz.)
rischio di infezione: eccezionale
elevate dosi di radiazioni alla prostata con contemporaneo risparmio delle strutture adiacenti
risultati oncologici a 12 anni sovrapponibili a quelli della chirurgia e superiori a quelli della radioterapia convenzionale a fasci esterni.
Svantaggi non sono a tutt’oggi disponibili risultati oncologici a lungo termine (15 anni dopo l’impianto), il che limita l’indicazione nei pazienti più giovani
disturbi irritativi minzionali per alcune settimane e talvolta sino a tre mesi dopo l’impianto (peraltro ben controllabili con una adeguata terapia medica):
aumento della frequenza minzionale e delle levate notturne nel 40% dei casi ritenzione urinaria acuta con cateterismo vescicale temporaneo 6,5 – 15% ritenzione urinaria cronica implicante intervento disostruttivo 2,6% rischio più elevato nei pazienti ostruiti
non consente il contemporaneo trattamento dei disturbi legati ad una eventuale condizione di ipertrofia prostatica concomitante
la fluttuazione del valore del PSA nei due anni successivi all’impianto può causare una reazione ansiosa nel paziente
costi elevati delle sorgenti radioattive a carico delle strutture sanitarie.
Conclusioni-Indicazioni
La BT può quindi essere proposta a tutti i pazienti affetti da adenocarcinoma prostatico localizzato con le seguenti caratteristiche:
età avanzata giovani con malattia poco aggressiva alto rischio anestesiologico e/o operatorio a rischio per patologie trombo emboliche affetti da turbe della coagulazione che richiedano un rapido ritorno alla normale vita socio-lavorativa con forte motivazione al mantenimento della potenza sessuale e di una perfetta continenza urinaria
La BT è invece controindicata nei pazienti
gravemente ostruiti (per l’elevato grado dei disturbi registrati nei primi tre mesi) molto giovani (selezione accurata in attesa dei risultati oncologici a 15 anni) che desiderino un subitaneo azzeramento del PSA dopo la terapia a comprovare l’efficacia della stessa
La BT viene infine proposta come monoterapia nel tumore prostatico localizzato, a basso rischio di avere diffusione extraprostatica; nei pazienti a rischio intermedio o alto di avere una malattia extraprostatica viene proposta in associazione alla radioterapia esterna.
BRACHITERAPIA – IMPIANTO TEMPORANEO
La Brachiterapia temporanea è una forma di radioterapia caratterizzata, come quella permanente, dalla possibilità di somministrare elevate dosi di radiazione a volumi bersaglio ben definiti, con un limitato coinvolgimento dei tessuti sani limitrofi.
Rispetto all’impianto permanente, in cui le sorgenti radioattive vengono impiantate definitivamente nella ghiandola, con questa tecnica la sorgente radioattiva viene temporaneamente portata all’interno della ghiandola attraverso dei sottili cateteri. Il paziente viene sottoposto ad una ecografia transrettale, sulla base della quale vengono stabiliti il numero e la posizione dei cateteri attraverso i quali la sorgente radioattiva verrà portata nella prostata. I cateteri vengono quindi infissi con approccio transperineale (tra ano e scroto) sotto guida ecografica, in analgo-sedazione o anestesia loco-regionale. Al termine della procedura di impianto dei cateteri, il paziente viene sottoposto ad una TAC della prostata per definire il piano di trattamento. Poiché la pianificazione viene eseguita dopo l’inserimento dei cateteri, ne è possibile una ottimizzazione in caso di errato posizionamento degli stessi.
L’utilizzo di radioisotopi per la Brachiterapia temporanea è attualmente limitato all’Iridio-192 ad alto rateo di dose (high dose rate-HDR).
Il trattamento radiante viene effettuato in un Bunker schermato (per limitare l’esposizione degli operatori alle radiazioni ionizzanti), dove un dispositivo afterloading (sistema di telecaricamento delle sorgenti) permette l’inserimento della stessa singola sorgente (con costi ridotti) nelle posizioni pianificate, e ne regola il tempo di permanenza tramite un software dedicato. La procedura è eseguibile in day-surgery. Vi sono svariati protocolli terapeutici che prevedono un numero variabile di sedute (da 1 a 8, ad intervalli settimanali), come monoterapia o in associazione ad un ciclo di radioterapia esterna. La più elevata energia dell’Ir-192 rispetto a quella delle sorgenti impiegate per impianti permanenti, consente una copertura dosimetrica più estesa, auspicabile in presenza di microinfiltrazioni capsulari; peraltro la più elevata energia ed il più elevato rateo di dose (tempo in cui la dose di radiazione viene rilasciata al bersaglio) pongono dubbi sulla tollerabilità dei tessuti normali circostanti, soprattutto del retto. Per questa forma di Brachiterapia mancano però a tutt’oggi i risultati oncologici a lungo termine.
RADIOTERAPIA ESTERNA
La radioterapia a fasci esterni consente, attraverso radiazioni ad alta energia emesse da un acceleratore lineare, di danneggiare in modo irreversibile le cellule tumorali maligne 
sino ad ottenerne la necrosi (morte cellulare). In una fase preliminare viene eseguita una simulazione di trattamento: vengono studiati i fasci di irradiazione più idonei ad ottenere dosi adeguate ed omogenee alla ghiandola prostatica, con il maggior rispetto possibile degli organi contigui (retto e vescica). Il trattamento prevede applicazioni giornaliere della durata di 10 minuti, 5 giorni alla settimana per complessive 7-8 settimane consecutive. L’irradiazione degli organi contigui alla prostata determina i più comuni e noti effetti collaterali a breve e a lungo termine a carico dell’apparato genitourinario ed intestinale: precocemente possono verificarsi un aumento della frequenza delle minzioni diurne e notturne (15% di grado severo), bruciore e urgenza minzionale, diarrea e urgenza alla defecazione, sanguinamento rettale (10-15% di grado severo). In genere questi effetti collaterali iniziano a manifestarsi durante il trattamento per poi risolversi, dietro adeguata terapia, entro tre mesi dal termine dello stesso. A lungo termine si possono riscontrare gravi cistiti da raggi con retrazione della vescica, ritenzione cronica urinaria (3%), incontinenza urinaria (2%), deficit erettile (40-70%), proctiti (6%), sanguinamento rettale persistente (<1%), necrosi delle teste femorali (<1%).
Dal punto di vista tecnico la radioterapia per i tumori prostatici può essere eseguita con diverse modalità: convenzionale, conformazionale 3D, “intensity modulated” (IMRT). Tutti gli studi più recenti dimostrano come il fattore “dose” in radioterapia abbia un ruolo fondamentale nel determinare la probabilità di guarigione del paziente. Le varie tecniche di radioterapia si differenziano proprio per la dose che consentono di rilasciare a livello prostatico e per il risparmio delle strutture contigue.
Radioterapia convenzionale: È la tecnica più datata ma è anche l’unica per la quale si disponga di risultati con follow-up a oltre 10 anni dal trattamento. Poiché utilizza campi piuttosto ampi che coinvolgono anche strutture adiacenti alla prostata, non consente di erogare dosi molto elevate alla ghiandola. A 10 aa dal trattamento i dati di sopravvivenza senza progressione biochimica di malattia sono per i tumori localizzati intorno al 5060% (75% stadio T1,66% T2, 30% T3)
Radioterapia conformazionale tridimensionale: È una tecnica di trattamento che consente, col procedere della terapia, di ridurre progressivamente il volume bersaglio irradiato “conformandolo” alle dimensioni della ghiandola prostatica. Questo permette di raggiungere dosaggi decisamente più elevati rispetto alla RT convenzionale con un maggior risparmio delle strutture adiacenti ed una riduzione degli effetti collaterali (8% di proctiti, tossicità urinaria grave circa 1%). Per contro non esistono dati relativi a pazienti trattati da più di 5 anni.
Intensity Modulated Radiation Therapy (IMRT): È la tecnica più recente: dovrebbe consentire, con l’utilizzo di software dedicati e di particolari accessori, di risparmiare maggiormente i tessuti sani adiacenti alla prostata, permettendo al contempo di irradiare quest’ultima con dosi molto elevate.
I risultati preliminari sono molto interessanti, anche se l’esecuzione del trattamento risulta decisamente più complessa e presenta quindi potenziali margini di errore superiori rispetto alle precedenti tecniche. Trattandosi di una metodica di recentissima introduzione il follow-up è ancora più breve rispetto alla conformazionale 3D.
TERAPIA ORMONALE
Il carcinoma della prostata è ormono-dipendente: lo scopo principale della terapia ormonale è pertanto quello di contrastare la produzione e di bloccare l’azione degli ormoni sessuali maschili prodotti da parte dei testicoli (testosterone) e dei surreni. Questo determina un rallentamento della proliferazione cellulare neoplastica e riduce le dimensioni del tumore.
Esistono due opzioni per ottenere una deprivazione androgenica: chirurgica e farmacologica.
Poiché la maggior parte degli ormoni sessuali maschili viene prodotta dai testicoli, la loro rimozione chirurgia (orchiectomia o castrazione) consente, con un intervento minore in day-surgery, di raggiungere l’obiettivo; l’orchiectomia chirurgica è peraltro psicologicamente mal accettata dai pazienti.
La castrazione farmacologica (“blocco androgenico”) viene ottenuta con l’impiego di farmaci che inibiscono la produzione di testosterone da parte dei testicoli (analoghi dell’LHRH) eventualmente associati a farmaci che antagonizzano l’azione degli ormoni sessuali maschili surrenalici (blocco androgenico completo). Questo trattamento è comunque gravato da una serie di effetti collaterali più o meno tollerati dal paziente quali: vampate di calore, perdita della libido, deficit erettile e in taluni casi tossicità epatica, cardiovascolare o intestinale, osteoporosi. Le indicazioni al solo trattamento ormonale nel carcinoma prostatico localizzato sono limitate a quei pazienti con spettanza di vita superiore ai 10 anni che non possono subire un trattamento chirurgico o radioterapico, o che rifiutano tali trattamenti; nei pazienti con spettanza di vita inferiore ai 10 anni (trattamento terapeutico opzionale) può avere un significato nel controllo della sintomatologia ostruttiva legata alla patologia. L’impiego del blocco ormonale viene spesso proposto ai pazienti per i quali il trattamento definitivo deve essere differito temporalmente: per periodi limitati (pochi mesi) questa indicazione non ha un significato terapeutico, ma solo quello di tranquillizzare il paziente ansioso di andare incontro ad una terapia.
Da ultimo la terapia ormonale può essere proposta prima e nel corso di un trattamento chirurgico o radiante (trattamento neoadiuvante) per tumori localizzati ma a rischio di estensione extracapsulare: non sono ancora disponibili i risultati finali di alcuni protocolli internazionali che dovrebbero chiarirne l’impatto in termini di sopravvivenza e di qualità di vita.
ATTESA
L’atteggiamento di vigile attesa (watchful waiting) consiste nella astensione da una qualunque forma di terapia sino alla comparsa di segni clinici o sintomi di progressione della malattia.
Sebbene possa apparire di difficile applicazione nel caso di una patologia sicuramente maligna come l’adenocarcinoma prostatico, esistono evidenze scientifiche che la vigile attesa rappresenterebbe la strategia più appropriata nei pazienti con aspettativa di vita inferiore ai 10 anni, affetti da piccoli tumori localizzati e ben differenziati (poco aggressivi). La maggior parte dei pazienti selezionati con tali caratteristiche, infatti, andrebbe incontro a decesso per altre malattie intercorrenti piuttosto che per cancro prostatico. I pazienti cui proporre la “vigile attesa” devono essere accuratamente selezionati: la
sopravvivenza a 10 anni nei pazienti cosi “trattati” scende infatti dall’87 % nel caso di tumori ben differenziati al 26% nelle forme più aggressive . Infine non deve essere trascurato il profilo psicologico del paziente, affetto da una neoplasia maligna, in considerazione della possibile reazione ansiosa che potrebbe derivare dalla astensione da qualsivoglia forma di trattamento.
TRATTAMENTI SPERIMENTALI
Alcuni Centri stanno valutando strategie terapeutiche alternative : l’obiettivo di tutti questi tentativi è di ottenere il controllo oncologico della malattia con una minore invasività e ridotta morbilità.
Si tratta di tecniche sicuramente interessanti ma delle quali ancora non si conoscono i risultati né a medio né a lungo termine ed è pertanto impossibile codificarne la sicurezza e l’efficacia. Al momento si tratta pertanto di protocolli a carattere sperimentale che possono essere proposti solo in casi selezionati: come terapie di salvataggio dopo fallimento delle terapie standard o qualora queste ultime non dovessero essere applicabili. Rientrano in questo gruppo la Crioterapia e HIFU ( termoterapia interstiziale indotta mediante radio ultrasuoni) che perseguono la distruzione del tessuto tumorale prostatico rispettivamente con il congelamento o l’induzione di un incremento termico.
